近日,我校生物反应器工程国家重点实验室、光遗传学与合成生物学交叉学科研究中心、药学院、上海市细胞代谢光遗传学技术前沿科学研究基地杨弋教授团队在rna光遗传学控制技术研究中取得突破性进展,在国际权威学术期刊《自然—生物技术》(nature biotechnology)以长篇论文(article)形式在线发表题为“optogenetic control of rna function and metabolism using engineered light-switchable rna-binding proteins” 的研究文章。

生物遗传中心法则是指遗传信息从dna传递给rna,再从rna传递给蛋白质,即完成遗传信息的转录和翻译的过程。然而在过去的几十年里,生命科学的舞台一直被 dna 和蛋白质霸占。dna 负责遗传信息存储,蛋白质负责基因指令执行,而 rna只是承担中间环节遗传信息传递者的配角。随着人类基因组信息的解析,人们发现只有2%的人类基因组编码蛋白质,更有约98%的基因组意义不明,甚至被认为是“垃圾”dna。随着生命科学的不断发展,这些看似“垃圾”的dna却能产生大量的非编码rna,而这些rna发挥着至关重要的生物学功能,几乎参与所有重要的细胞生命过程,与多种重大疾病的发生和发展密切相关。
细胞内的rna像蛋白质一样具有复杂的高级结构与相互作用,具有特定的时间、空间分布及不同的转录后修饰状态,复杂而精确地执行丰富多彩的生物学功能。与蛋白质研究相比,人们对细胞内rna时间空间分布及其功能的研究目前仍然有一定滞后,其中一个重要的原因是目前仍缺乏可以在活细胞内对rna分子进行实时监测与精密控制的技术,这是深入研究rna功能机制面临的关键问题和重要技术挑战,也是国际上rna研究领域的前沿热点。在rna监测技术研究方面,杨弋教授与朱麟勇教授组成的交叉学科联合攻关团队此前发展了pepper系列高性能荧光rna,在国际上首次实现了动物细胞内不同种类rna的标记与无背景成像(nature biotechnology, 2019; nature chemical biology, 2021),解决了活细胞rna实时标记与成像的难题。在rna控制技术研究方面,杨弋教授团队此前发展了系列lighton/lightoff光控转录系统,实现rna生成的时间和空间精密控制(nature methods, 2012; nature communications, 2021; cell research, 2016; nucleic acids research, 2016, 2020)。然而,活细胞rna在转录后还有一系列的代谢行为,如剪接、修饰、运输、翻译、降解等,它们对rna的正常生物学功能发挥同样至关重要。因此,发展活细胞rna转录后代谢精密控制技术将会极大促进人们对于rna的复杂功能与调控机制的解析。针对这一亟需解决的技术挑战,杨弋教授团队历经多年辛苦耕耘,最终在活细胞rna精密控制领域取得了突破性进展。基于合成生物学及光遗传学原理,他们成功构建了系列光控rna效应因子,实现了动物细胞内rna生成、剪接、运输、翻译、降解等代谢活动的高时空分辨精密控制。
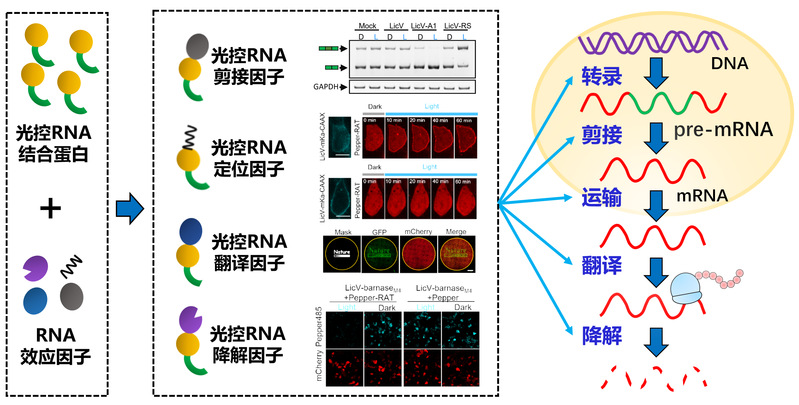
研究团队首先基于合成生物学理性设计并结合全新的高通量筛选策略,构建了国际上首个人工合成的光控rna结合蛋白licv。licv由rna结合结构域与lov光敏结构域融合构成,分子量仅为23 kd。在黑暗条件,licv是以单体形式存在,不能结合特定的rna序列(rat);在蓝光照射下,licv形成同源二聚体并特异性识别结合rat序列。研究团队随后将licv与不同的rna效应结构域融合,分别获得光控rna剪接因子、光控rna定位因子、光控rna翻译因子以及光控rna降解因子。他们利用这些光控rna效应因子实现了活细胞rna剪接、运输、翻译、降解等转录后代谢的时间和空间精密控制。此外,研究团队还将licv与crispr-cas系统结合起来,发展了全新的la-crispr系统。在该系统中,含rat序列的嵌合sgrna可以招募光照诱导产生的licv-vpr光控转录因子二聚体,从而启动目的基因转录与表达。通过在sgrna中引入多个拷贝的rat序列,la-crispr对目的基因的激活效率是前人发展系统的一到三个数量级。利用la-crispr系统,研究团队还实现基因位点的高亮度与可逆标记。此外,la-crispr系统具有很好的普适性,可应用于多个物种来源的crispr-cas系统。
论文第一作者为华东理工大学生物工程学院刘韧玫博士与杨菁博士,通讯作者为药学院陈显军博士和杨弋博士。该前沿交叉学科研究得到了华东理工大学生物工程学院全舒教授与蔡海波教授的协助。该研究得到了国家重点研发计划、国家自然科学基金、上海市科委项目、上海市细胞代谢光遗传学技术前沿科学研究基地、“111”计划、生物反应器工程国家重点实验室基金、教育部基本科研业务费等经费资助。
原文链接:https://www.nature.com/articles/s41587-021-01112-1