近日,我校药学院何薇薇课题组与中国科学院上海有机化学研究所李昂课题组合作,发现吲哚萜天然产物hapalindole q是一个机制独特的自噬后期抑制剂,并揭示其通过降解yap1干扰自噬体与溶酶体融合的作用机制,相关成果以hapalindole q suppresses autophagosome−lysosome fusion by promoting yap1 degradation via chaperone-mediated autophagy为题发表于《美国科学院院刊》(proceedings of the national academy of sciences of the united states of america, pnas)。
自噬是真核细胞中一种重要的分解代谢过程,主要作用是清除冗余或异常的细胞成分,同时回收细胞内的营养物质,以维持细胞稳态,使其适应环境变化。在哺乳动物细胞中,自噬主要有三种类型:巨自噬(macroautophagy)、微自噬 (microautophagy) 和分子伴侣介导的自噬 (chaperone-mediated autophagy, cma)。自噬功能异常与癌症、神经退行性疾病、心血管疾病、代谢性疾病等多种疾病的发生和发展密切相关。因此,精确调控自噬有望成为针对这些疾病的一种治疗策略。目前,大多数小分子自噬抑制剂主要通过干扰自噬起始过程或破坏溶酶体活性来发挥作用,发现具有新颖机制的小分子自噬抑制剂具有重要价值。
吲哚萜是一大类具有吲哚和萜类杂合结构的天然产物。hapalindole家族天然产物是一类从海洋蓝藻中发现的吲哚萜,其化学合成和生物合成备受关注。李昂课题组前期利用prins环化策略,实现了该家族多个成员和系列类似物的合成 (angew. chem. int. ed. 2014, 53, 13840)。然而,该类天然产物的生物学功能和作用机制仍然知之甚少。何薇薇–李昂合作团队发现,该家族代表性成员hapalindole q在肝细胞癌hep g2细胞中显著上调自噬标志蛋白lc3b。通过将该化合物与自噬诱导剂雷帕霉素或自噬抑制剂氯喹联用,初步判定其为自噬后期抑制剂。利用mcherry−egfp−lc3b双荧光指示体系,观察到hapalindole q导致自噬体累积和自噬溶酶体减少,进一步验证了该化合物的对自噬后期过程的抑制效应。与常见的自噬后期抑制剂 (如巴佛洛霉素a1) 不同,hapalindole q不影响溶酶体酸度和关键蛋白酶活性,因此可能影响自噬体与溶酶体的融合过程。鉴于hippo信号通路在融合过程中的调控作用,合作团队检测了hapalindole q该通路效应蛋白yap1的影响,发现该化合物显著下调yap1,进一步确认此下调是通过溶酶体途径,而不是常见的泛素–蛋白酶体途径介导的降解。利用sirna敲低伴侣蛋白hsc70或溶酶体表面受体lamp2a,显著减弱了hapalindole q下调yap1的效果,表明该化合物通过cma降解yap1。过表达yap1能够抵消该hapalindole q的自噬抑制作用,证实该化合物通过降解yap1影响自噬体与溶酶体融合。该化合物还被发现干扰融合过程关键蛋白rab7在细胞内的正常分布。随后,合作团队利用细胞热迁移和生物膜干涉两种技术,确证hapalindole q能够直接结合yap1,且天然对映体的结合力强于非天然对映体。初步的构效关系研究表明,hapalindole的基本骨架对结合至关重要,而异硫氰酸酯基团则非必需。
此项研究不仅鉴定了一种机制新颖的巨自噬抑制剂,还揭示了yap1在细胞质中调控自噬体与溶酶体融合的功能,并为直接靶向柔性蛋白yap1提供了一类新型分子骨架,有望推动自噬相关疾病及hippo–yap相关疾病的先导化合物发现。从更广阔的角度来看,这项工作强调了深入机理表征在发掘天然产物的生物学功能潜力中的重要性。
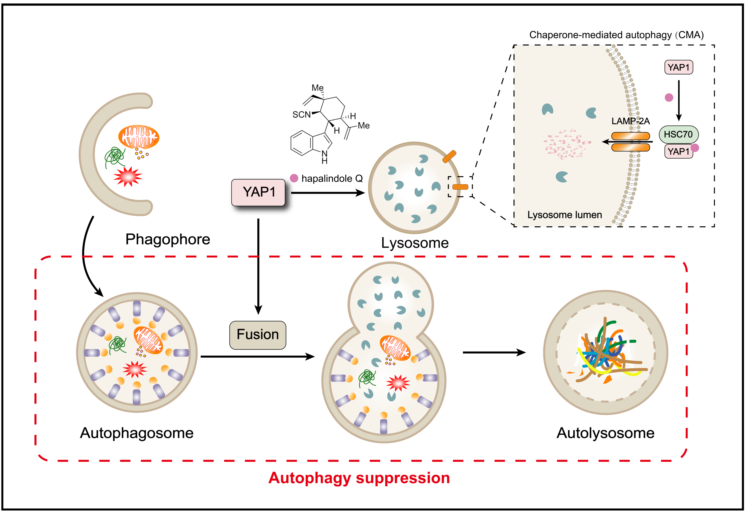
图片说明:天然产物hapalindole q的作用机制示意图。该化合物与yap1结合,并诱导其通过伴侣介导自噬发生非经典降解。这一过程影响了自噬体与溶酶体融合,从而抑制了巨自噬。
华东理工大学研究生吴亚丽和王少男、上海有机所研究生郭志聪、华东理工大学研究生孙敏为相关论文的共同第一作者。中国科学院生物与化学交叉研究中心刘聪课题组在研究中提供了重要帮助。此项研究受到了国家自然科学基金委、中国科学院、上海市科委等机构的资助。
原文链接: